Chimie 504 (2020-2021)
Afdeling uitkomste
-
Clique sur les liens ci-dessous :
M. Bacchi : Notes de cours / Labo / Exercices
Mme Cayouette : Notes de cours / Labo / Exercices
M. Levan : Agenda / Notes de cours / Labo / Exercices / Cours à distance
Annonces!
- Bon retour!
- Formulaire de retour de M. Levan mise à jour: https://forms.gle/xrnBT3qtomfGKNrg7
- Playlist FEELS + HYPE (v. mars 2021) maintenant dispo dans la section Cours à distance
- Calendrier de mars mise à jour (dispo section Agenda / Cours à distance)
- Formulaire de retour de M. Levan mise à jour: https://forms.gle/xrnBT3qtomfGKNrg7
- Rappel: Autre Sections > Évaluations pour voir tous tes tests
- Bon retour!
-
-
-
-
- Mot de bienvenue
- Révision et mise à niveau
- Le modèle atomique simplifié
- Le tableau périodique
- La notion de mole
- La stœchiométrie
-
Objectifs de l'élève:
- Pouvoir expliquer un phénomène macroscopique (volume, température, pression, quantité) à l’aide de la théorie cinétique (p. 35-37, p. 50-51)
- Nommer et expliquer la conséquence des quatre hypothèses de la théorique cinétique (p. 41-42)
- Particule à masse fixe, volume négligeable
- Constamment en mouvement et aléatoire
- Collisions élastiques
- Distribution des vitesses proportionnelle à la température
- Résolution de problème avec lois simples (p.66 à 81)
-
Objectifs de l'élève:
- Résolution de problèmes avec loi des gaz parfaits (p.98)
- Définir les 3 caractéristiques d'un gaz parfait
- Comparer un gaz parfait à un gaz réel
- Résolution de problèmes avec loi générale des gaz (p.92)
-
Objectifs de l'élève:
- Loi des pressions partielles (Dalton)
- Lecture d’un manomètre – absolue et relative
- Calcul de pression partielle d’un gaz selon un mélange et une pression totale
- Calcul de la composition d’un mélange selon les pressions partielles et la pression totale
- Calcul stoechiométriques
- Résolution de problèmes avec loi des gaz parfaits et loi générale des gaz avec calcul stœchiométrique
- Propriétés chimiques des gaz (pas évalué dans le test)
- Loi des pressions partielles (Dalton)
-
Objectifs de l'élève:
4.1
- Identifier le type d'énergie présent dans une situation (révision 4e sec.)
- Identifier le transfert ou la transformation d'énergie dans une situation (révision 4e sec.)
- Résolution de problèmes avec Q=mcΔT (calcul de chaleur absorbée ou dégagée)
- Analyse de courbe de chauffage
5.1
- Identifier le système (ouvert, fermé ou isolé)
- Identifier le sens de l'échange d'énergie (Qréaction et Qmilieu)
- Résolution de problèmes calorimétriques avec Q=mcΔT avec de l'eau ou substance aqueuse
4.2
- Identifier si la situation/réaction est endothermique ou exothermique
- Analyser une équation thermique
- Stoechiométrie
- Endo/exo
- Calcul et résolution de problèmes sur la chaleur molaire de réaction
- Similairement, chaleur massique de réaction
- Calcul de variation d'enthalpie
- Représentation graphique de la variation d'enthalpie
-
Objectifs de l'élève test 2:4.3
- Bilan énergétique
- Calculer le bilan (l’énergie nécessaire pour absorber et dégager) lorsqu’on brise les liens ou lorsqu’on forme des liens
- Analyse complète d’un diagramme énergétique:
- Enthalpie des réactifs, enthalpie des produits, enthalpie du complexe activé, énergie d’activation, énergie d’activation de la réaction inverse
- Comparaison de différents réactions ayant une énergie d’activation différente
5.2 – loi de Hess- Résolution de problèmes loi de Hess complète : je te donne une équation et tu dois me trouver le ∆H à l’aide d’un tableau de ∆H°f
- Tu dois être capable de trouver les équations thermiques des réactions de formation
- Résolution de problèmes où tu me trouve l’équation thermique finale et la chaleur de réaction selon une liste d’équations intermédiaires
- Analyse de diagramme énergétique ayant plusieurs étapes (4.3 appliqué)
- Bilan énergétique
-
Objectifs de l'élève module 6:
- 6.1
- Description de vitesse de réaction selon conditions expérimentales
- Relation entre vitesse de divers réactifs et produits et vitesse générale d’une réaction
- Vitesse moyenne d’un réaction – interprétation graphique
- 6.2 – 6.3
- Modèle cinétique des réactions (collisions)
- Analyse graphique – étape déterminante, étape la plus lente
- Facteurs qui influencent vitesse de réaction
- Identification de catalyseurs (graphique et par équation)
- 6.4
- Loi de vitesse de réaction : trouver la loi selon la méthode des vitesses initiales
- Trouver l’ordre selon les réactifs et l’ordre général selon les données expérimentales
- 6.1
-
Objectifs de l'élève
- 7.1 – Identifier si un système est à l’équilibre (vitesse directe = inverse)
- Réaction réversible
- Système fermé
- Propriétés macroscopiques constantes
- 7.2 – Principe de Le Chatelier
- Identifier les perturbations aux système (concentration des réactifs, concentrations des produits, variation de température, variation de pression)
- Prédire comment le système va réagir
- Prédire comment les substances vont varier pour rétablir un nouvel équilibre
- 7.3 – Mise en pratique du principe de Le Chatelier
- Synthèse des connaissances dans tout le chapitre. Fais attentions aux pièges!
-
Attention!
Le corrigé va toujours prendre en considération le changement net, donc le corrigé prend en considération la perturbation au système. Cependant, moi je veux que tu considère ce que le système va faire suite à la perturbation, donc tu ne dois pas considérer la perturbation.
- 7.1 – Identifier si un système est à l’équilibre (vitesse directe = inverse)
-
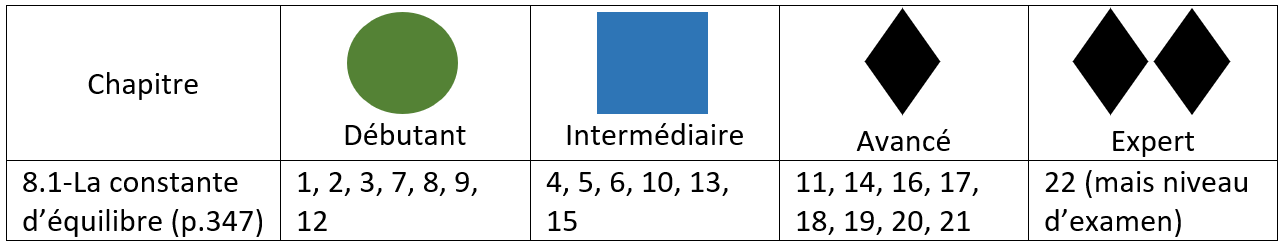
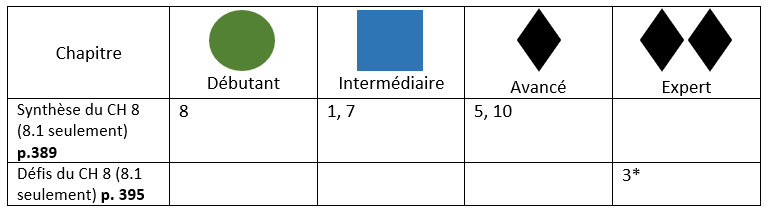
Objectifs de l'élève (8.1)
- Constante d’équilibre
- Interpréter une constante d’équilibre
- Quelle réaction sera favorisée
- Impact de variation de température sur la constante
- Calculs reliés à Kc
- Les données sont à l’équilibre
- Les données sont des concentrations initiales (tableau ICE)
- Constante d’équilibre
-
-
-
-